《食品工业科技》客座主编专栏:南昌大学戴涛涛讲师|动物蛋白与植物蛋白对甜菜苷的热保护作用机制研究
导读
2023年4月,南昌大学食品科学与技术国家重点实验室及广西果蔬贮藏与加工新技术重点实验室戴涛涛老师课题组在国家综合性科技期刊《食品工业科技》发表题为《动物蛋白与植物蛋白对甜菜苷的热保护作用机制研究》的论文。南昌大学戴涛涛老师为通讯作者,南昌大学胡婷硕士研究生为第一作者。论文得到了国家自然科学基金青年基金项目资助(32101948)和广西自然科学基金项目资助(2022GXNSFBA035522)的资助。
图片来源于图司机
本论文为探究不同蛋白质对甜菜苷的热保护作用,明晰其保护机制,采用两种动物蛋白(乳铁蛋白和β-乳球蛋白)、两种植物蛋白(大米蛋白和大豆分离蛋白)为原料,采用浊度、紫外光谱、粒径、分子模拟等手段表征蛋白-甜菜苷复合物的形成和相互作用机制。本研究为蛋白天然色素的相互作用及甜菜苷的护色研究提供理论基础。
实验方法
文章亮点
1 蛋白质对甜菜苷热稳定性的影响
图1 白质对甜菜苷热稳定性的影响
四种蛋白质均能提高甜菜苷的热稳定性,保护效果为:乳铁蛋白>大豆分离蛋白>β-乳球蛋白≈大米蛋白,蛋白质对甜菜苷热稳定性的提高与蛋白-甜菜苷复合物的形成有关。 2 蛋白质-甜菜苷复合物浊度的表征
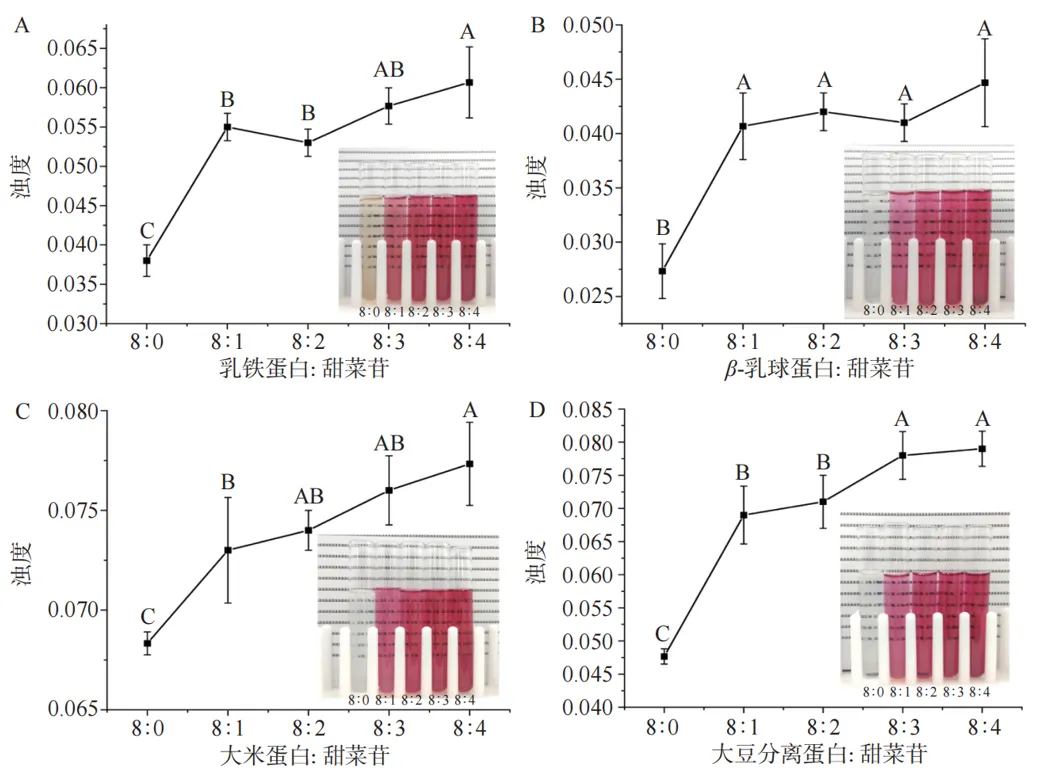
图2 甜菜苷含量对蛋白质浊度的影响
胶体体系的浊度取决于胶体粒子的数量、大小和折射率。胶体复合物的粒径越大,数量越多,其光透过率则越小,其浊度也越大。胶体复合物的形成可通过样品的浊度变化初步证明。 结果表明,当将蛋白质与甜菜苷的比例从8:0增加到8:4时,蛋白质的浊度随着甜菜苷比例的增加而显著增加(P<0.05),从外观上可以观察到溶液变得越来越浑浊,且静置24 h后未出现沉淀和聚集现象,这些结果表明蛋白质乳铁蛋白、β-乳球蛋白、大米蛋白、大豆分离蛋白与甜菜苷形成了稳定的胶体复合物,具有较强的抗重力作用。
3 蛋白质-甜菜苷复合物紫外光谱的变化
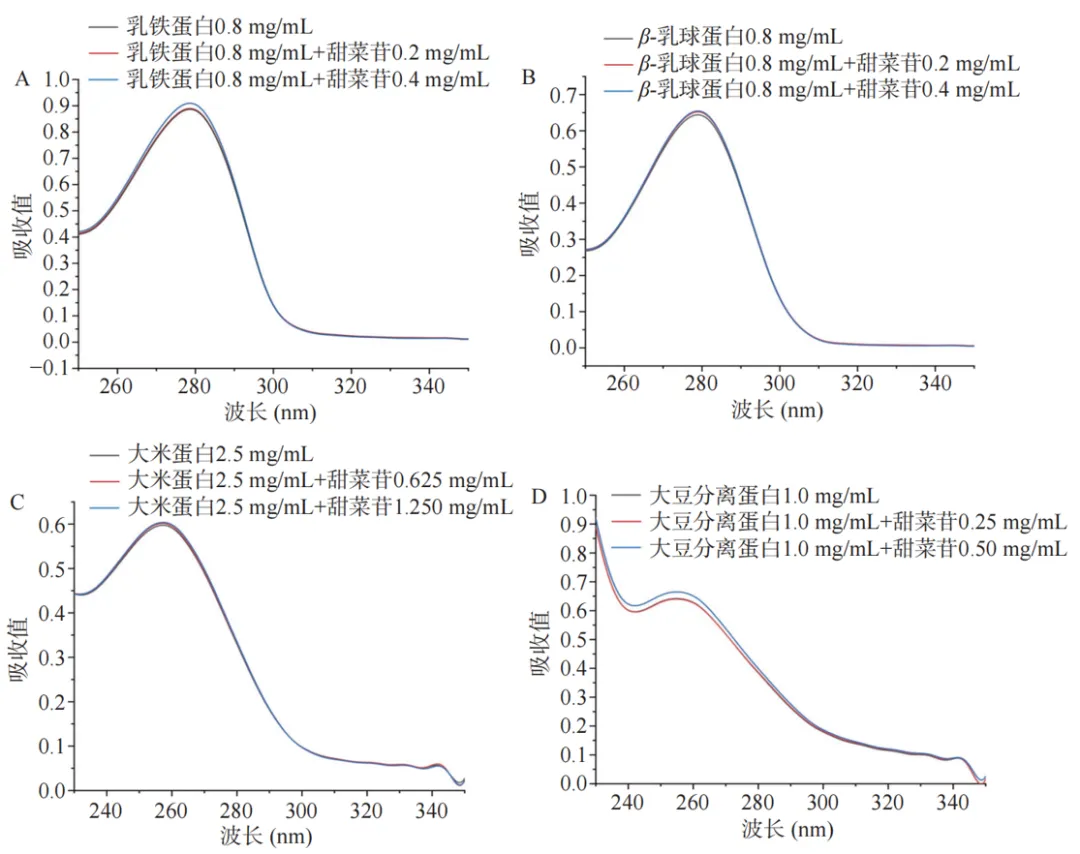
图3 甜菜苷浓度对蛋白质紫外光谱的影响
蛋白质分子中芳香氨基酸残基微环境的变化可能会改变蛋白质的紫外吸收。蛋白质的紫外吸收随着配体小分子的加入而增强可作为判断二者是否结合的有力依据。 结果表明,从四种蛋白质紫外光谱的变化可看出,蛋白质紫外吸收增强的程度和其对甜菜苷的热保护效果呈现正相关,这意味着蛋白质对甜菜苷的热保护效果与甜菜苷-蛋白结合程度有关。
4 蛋白质-甜菜苷复合物粒径的变化
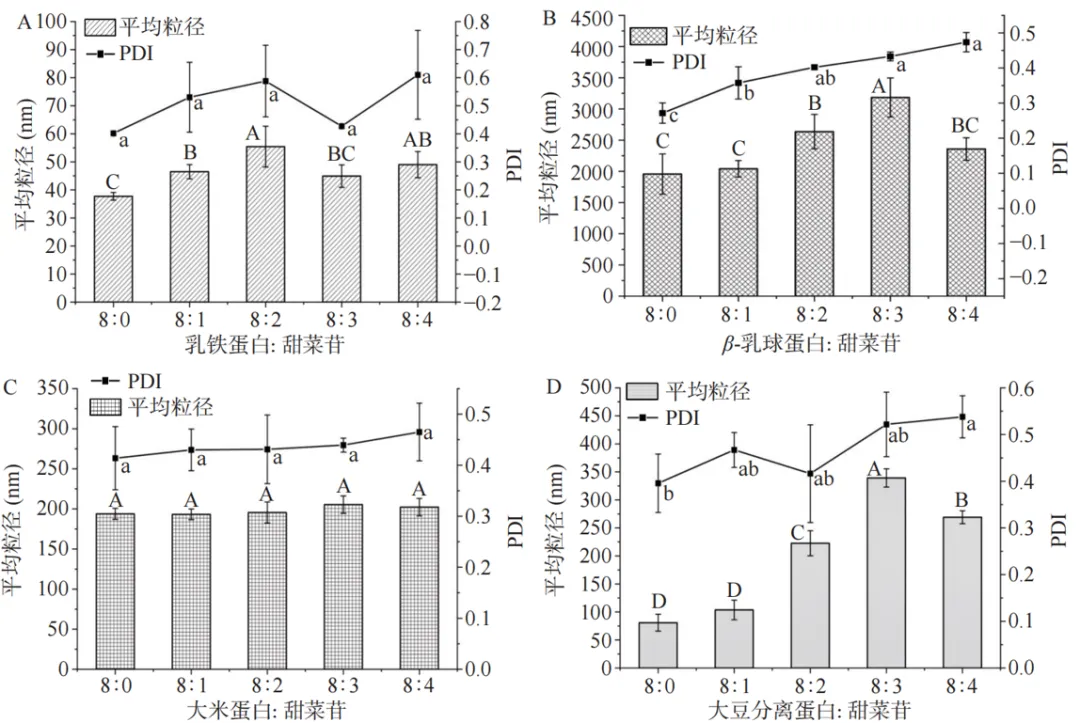
图4 甜菜苷浓度对蛋白质-甜菜苷复合物粒径的影响
蛋白质与配体小分子发生相互作用后常常形成聚集的复合物,导致粒径增大。 结果表明,乳铁蛋白、β-乳球蛋白、大豆分离蛋白与甜菜苷复合后引起了蛋白质的聚集,导致了粒径的增大。而大米蛋白-甜菜苷的粒径随着甜菜苷含量的增加并无显著性差别(P> 0.05),这可能说明大米蛋白与甜菜苷之间没有形成聚集性复合物,或是大米蛋白与甜菜苷之间的相互作用过弱而无法引起聚集。这个现象与紫外光谱的结果吻合,甜菜苷与乳铁蛋白、β-乳球蛋白、大豆分离蛋白的结合比与大米蛋白的结合更加紧密。
5 蛋白质的表面形态
图5 不同蛋白质的表面形态
甜菜苷是一种水溶性色素,更加亲水的环境能够容纳更多的甜菜苷。因此,蛋白质的表面结构或许与它们的相互作用有关。 从结构上而言,乳铁蛋白、大米蛋白和大豆分离蛋白均具有褶皱型的粗糙表面,可能有更多与小分子相互作用的位点,有利于它们与甜菜苷发生相互作用。 从溶解性方面,乳铁蛋白、β-乳球蛋白是高溶解度的动物蛋白,大豆分离蛋白是一种溶解性较高的植物蛋白,然而大米蛋白因具有高度的表面疏水性而难以溶解,因此可能与甜菜苷结合的蛋白含量较少,且较低的表面亲水性也导致了其缺乏足够的甜菜苷结合位点。这可能是大米蛋白与甜菜苷的结合能力远小于其他三类蛋白的原因。
6 蛋白质与甜菜苷的相互作用机制
图6 蛋白质与甜菜苷的相互作用
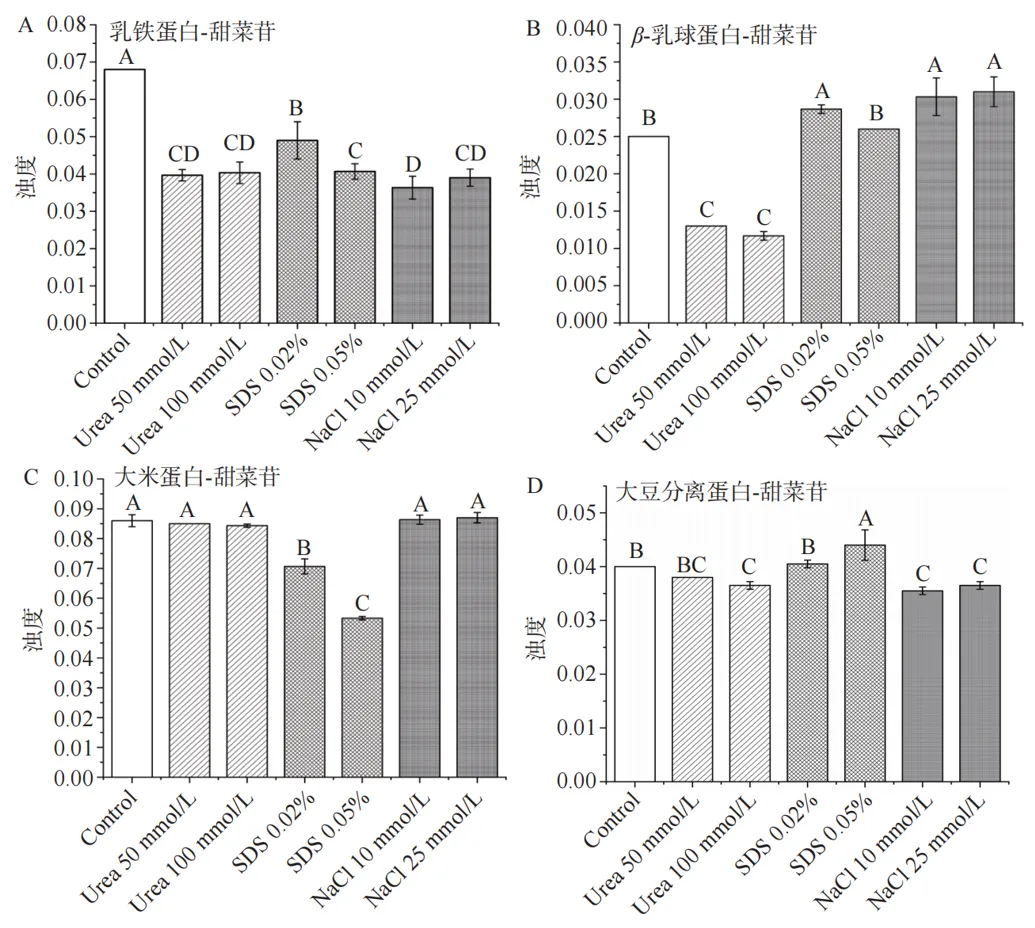
采用了添加干扰剂并测定浊度的方法表征蛋白质与甜菜苷之间存在的相互作用力。 由图6A可看出,乳铁蛋白-甜菜苷复合物的浊度随着干扰剂的添加而降低,且尿素和氯化钠的干扰效果最强,该结果表明,在乳铁蛋白-甜菜苷复合物中存在着氢键、疏水作用力和静电相互作用,而氢键和静电相互作用占主导地位;图6B显示了干扰剂对β-乳球蛋白-甜菜苷复合物的影响,结果表明,氢键是β-乳球蛋白与甜菜苷结合的主要作用力;在图6C中,疏水作用力是大米蛋白-甜菜苷复合物的主要相互作用力;图6D显示了三种干扰剂对大豆分离蛋白-甜菜苷复合物浊度的影响,结果表明,尿素和氯化钠使得复合物的浊度略有下降,表明在大豆分离蛋白-甜菜苷复合物中存在氢键和静电相互作用。
7 分子对接模拟
图7 蛋白质与甜菜苷的分子对接结果
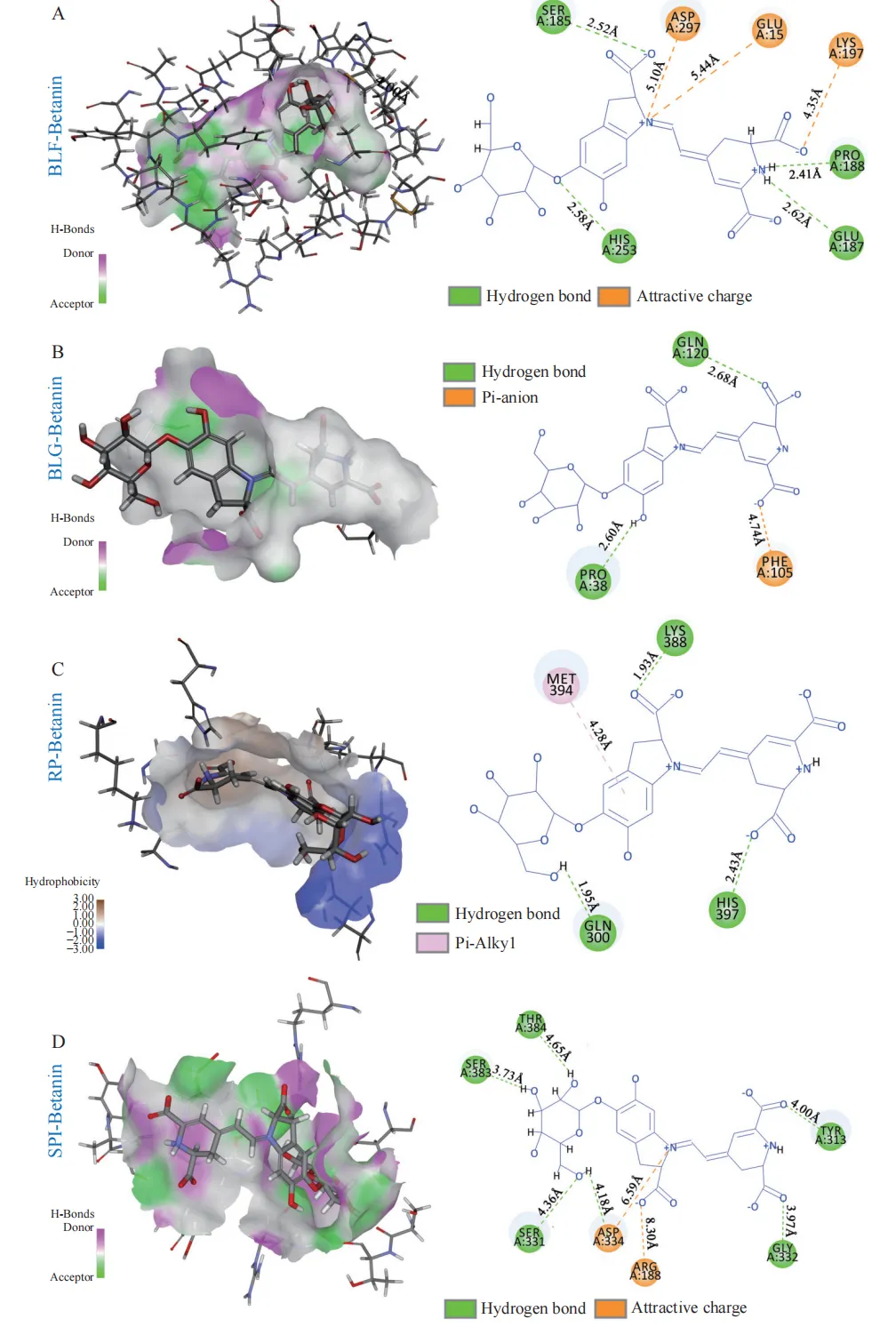
将乳铁蛋白、β-乳球蛋白、大米蛋白、大豆分离蛋白四种蛋白质分别与甜菜苷进行分子对接模拟,以确认蛋白质与甜菜苷的结合位点,结果如图7所示。
总结展望
本文研究了两种动物蛋白和两种植物蛋白对甜菜苷热稳定性的影响,并探究了保护作用机制。四种蛋白质均能提高甜菜苷的热稳定性,保护效果为:乳铁蛋白>大豆分离蛋白>β-乳球蛋白≈大米蛋白,蛋白质对甜菜苷热稳定性的提高与蛋白-甜菜苷复合物的形成有关。通过浊度、紫外光谱、粒径的实验结果推测,甜菜苷与乳铁蛋白、β-乳球蛋白、大豆分离蛋白的结合程度高于大米蛋白,这可能是由于大米蛋白的低溶解度和紧密结构造成的。此外,相互作用和分子对接的结果显示,乳铁蛋白与甜菜苷主要通过氢键和静电相互作用结合,β-乳球蛋白与甜菜苷主要通过氢键发生相互作用,大米蛋白与甜菜苷主要通过疏水相互作用结合,大豆分离蛋白与甜菜苷主要通过氢键和静电相互作用结合。 本文为蛋白质提高甜菜苷稳定性的研究提供了理论基础,拓宽了提高甜菜苷稳定性的可用蛋白质资源范围。今后可继续探究更多可提高甜菜苷热稳定性的蛋白质资源,并深入研究能够有效提高甜菜苷稳定性的蛋白质具有的共性特征,将蛋白质-甜菜苷的相互作用及热保护作用的研究系统化。 通讯作者简介
戴涛涛,美国麻省大学和南昌大学联合培养博士,硕士生导师,南昌大学食品学院讲师,江西省科技特派员,入选江西省高层次人才“双千计划”创新领军青年人才,广西博士后创新人才支持计划(桂博新计划)。
研究方向为植物蛋白资源挖掘与高值化利用;食品加工关键技术研究与产业化开发。主持国家自然科学基金青年基金、中国博士后面上项目、省级青年基金等项目,参与“十四五”国家重点研发计划“乡村产业共性关键技术研发与集成应用”专项。获江西省科技进步二等奖,江西省优秀博士学位论文,入围第一届全国博士后创新创业大赛总决赛。发表SCI/EI论文125篇,其中SCI论文96篇,先后入选ESI高被引论文6篇,谷歌学术H指数32,被引2800余次。以第一或通讯作者发表SCI/EI论文38篇,其中SCI论文30篇(ESI高被引论文3篇,热点文章1篇),均篇IF=7.4,均为JCR一区,中科院一区25篇(>80%)。授权国际专利2件,授权发明专利14件。副主编十四五规划教材1部。担任《Journal of Future Foods》和《南昌大学学报(工科版)》青年编委,《Foods》期刊学术编委,Food Hydrocolloids、Food Chemistry等10余个SCI期刊审稿专家。
来源:食品工业科技编辑部