南昌大学罗韬、王小磊教授《Adv. Mater.》| 鼻腔内递送近红外和磁性双响应纳米球可快速产生抗抑郁和认知增强作用
文献解读
抑郁和认知障碍已成为许多精神障碍(抑郁症、痴呆症、躁郁症和精神分裂症)致残的主要原因,困扰着数亿患者,损害了他们的日常生活质量和心理健康,甚至在某些情况下导致死亡和自杀。抑郁和认知障碍通常与单胺类递质通路失调有关。在大多数情况下,一线临床药物已证明在疾病控制方面有效。然而,出现了几个挑战,包括起效慢、疗效有限、副作用、停药后症状反弹和药物依赖性,所有这些都导致患者依从性不佳。此外,给药效率受到肠道屏障和血脑屏障(BBB)的阻碍,使药物开发变得困难。
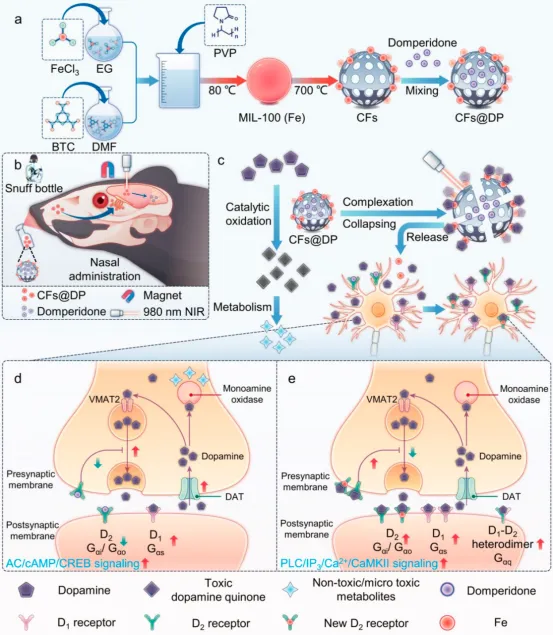
近日,来自南昌大学的罗韬、王小磊团队从中世纪贵族常用的一种精致工具——鼻烟壶中获得灵感,开发了一种由碳化的MIL-100(Fe)框架(CFs)和多潘立酮(DP)组成的光磁响应鼻腔给药系统(记为CFs@DP),其可通过鼻腔给药进入脑部,并在近红外(NIR)照射和儿茶酚胺诱导络合的双重刺激下,解体释放铁离子和DP,导致多巴胺1型(D1)、2型(D2)受体和脑源性神经营养因子(BDNF)上调,达到抗抑郁和认知增强效果(图1)。
相关研究成果以“Intranasal Delivery of Near‐infrared and Magnetic Dual‐response Nanospheres to Rapidly Produce Antidepressant‐like and Cognitive Enhancement Effects”为题于2024年5月23日发表在《Advanced Materials》上(IF = 29.4)。
CFs@DP的表征
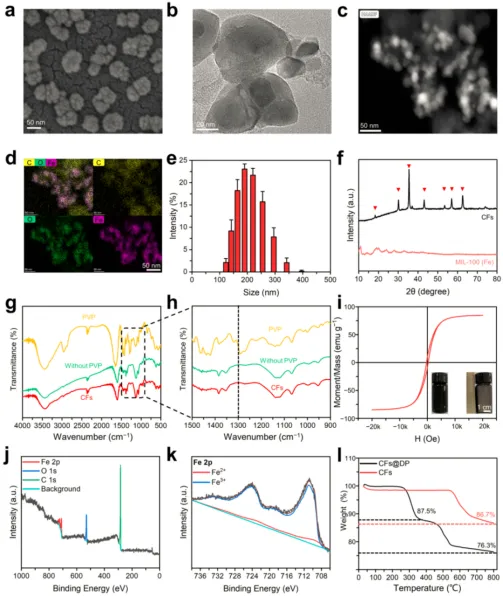
从SEM和TEM图像可以观察到CFs的横向尺寸约为60 nm,呈桑葚状(图2a和2b)。HAADF-STEM图像获得的元素映射数据显示,CFs的结构呈现由碳连接的γ-氧化铁(γ-Fe2O3)组成的球形框架(图2c和2d)。DLS结果表明,CFs在水中团聚,粒径较大,约为200 nm(图2e)。CFs的XRD图谱表明Fe主要以Fe3O4和γ-Fe2O3的形式存在(图2f)。FT-IR光谱表明PVP(典型峰在1300cm-1)已在碳化过程中从CFs中去除(图2g和2h)。使用VSM量化了CF的磁化强度,结果显示CF表现出优异的顺磁性(图2i),XPS图谱表明Fe主要以γ-Fe2O3的形式存在于CF中(图2j和图2k)。TGA分析表明CFs和CFs@DP的失重率分别约为86.7%和76.3%(图2l)。根据TGA分析估计药物负载率约为12.5%,通过直接称重估计药物负载率约为14.3% ± 2.5%。
近红外响应能力和与儿茶酚胺的化学反应能力
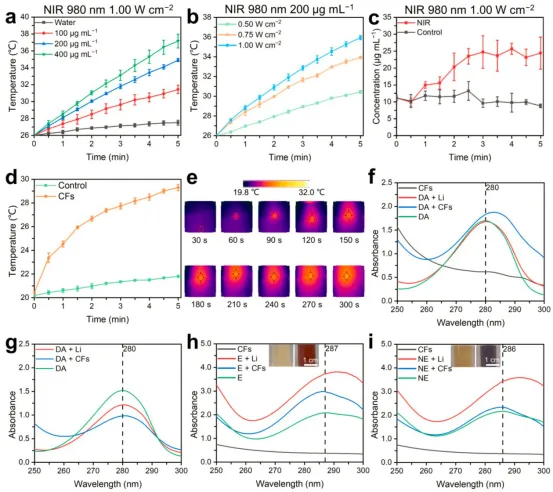
用NIR辐照的CFs升温明显,而纯水温度上升不明显,这种差异表明CFs对NIR具有优越的光热响应性能(图3a和3b)。体外释放实验结果表明CFs可以在NIR的刺激下释放药物(图3c)。采用20 mm厚琼脂作为组织模拟介质来评估深层温度的变化,结果显示,在NIR照射下,CFs的温度在5 min内上升了约8.7 °C,该结果为CFs@DP在深层组织中的可控崩解提供了基础(图3d和3e)。
为了研究CFs与儿茶酚胺混合后的反应,将CFs和碳酸锂(Li2CO3)进行了比较,从结果可以推断出,当CFs与多巴胺(DA)、肾上腺素(E)和去甲肾上腺素(NE)结合时,可能会诱导其崩解,且Li2CO3倾向于与E和NE发生反应,这与双相情感障碍的临床治疗一致(图3f-3i)。
CFs@DP的生物相容性评估
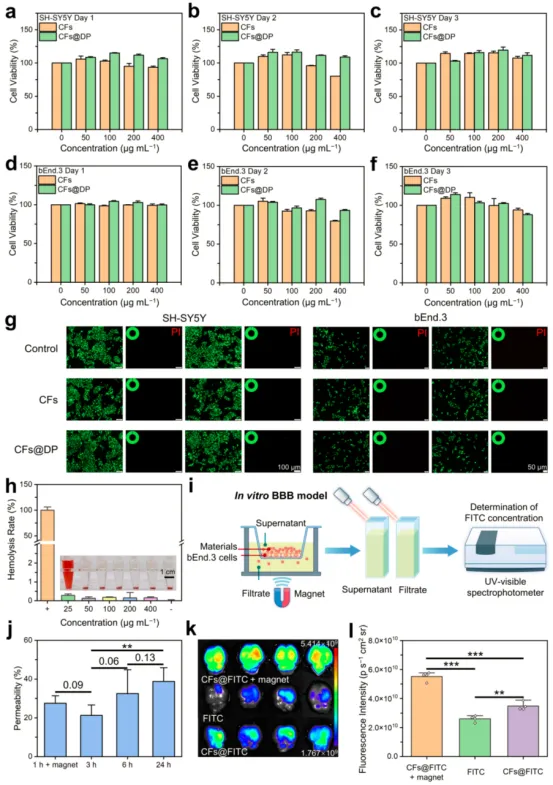
CFs和CFs@DP对人神经母细胞瘤(SH-SY5Y)细胞和小鼠脑微血管内皮(bEnd.3)细胞的毒性作用结果显示,在孵育2天时,由CFs(> 200 μg/mL)引起的急性毒性被DP减轻(图4a-4f)。Calcein-AM/PI染色实验结果表明,200 μg/mL的CFs@DP与SH-SY5Y细胞和bEnd.3细胞共培养时具有良好的生物相容性(图4g)。不同浓度的CFs与红细胞共培养时均未观察到明显的溶血(图4h)。通过构建一个致密的bEnd.3细胞屏障模型来模拟CFs@DP可能穿过的屏障,结果显示磁辅助可以显著增强CFs穿过细胞屏障的能力(图4i和4j)。与单独的FITC相比,CFs@FITC表现出更好的脑通透性,表明CFs可以作为载体通过鼻腔给药进入大脑。此外,磁辅助可以进一步提高CFs的脑通透性(图4K和4i)。
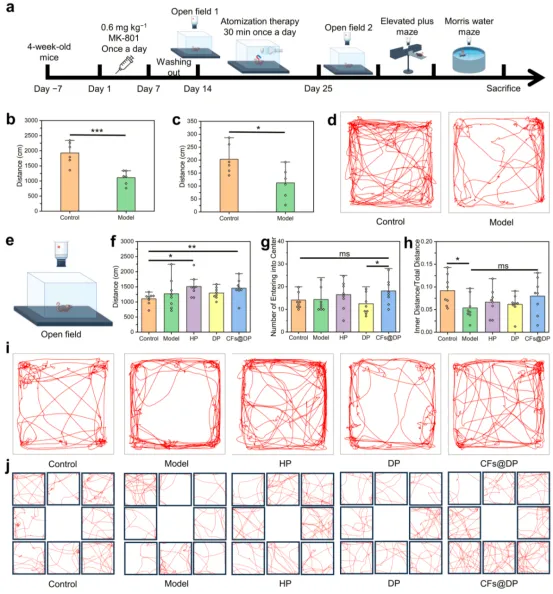
不同处理方法的OF及行为学实验
通过给小鼠腹腔注射高剂量的地佐环平(MK-801)诱发焦虑、抑郁和认知障碍症状,作为精神分裂症模型(图5a)。经过7天的冲洗期(临床试验的招募和随机分组阶段之间的一个时期),不同组小鼠在旷场(OF)实验中的行为仍有明显差异,表明建模成功(图5b-5d)。用CFs@DP治疗后,小鼠的抑郁和焦虑症状得到改善(图5f-5j)。
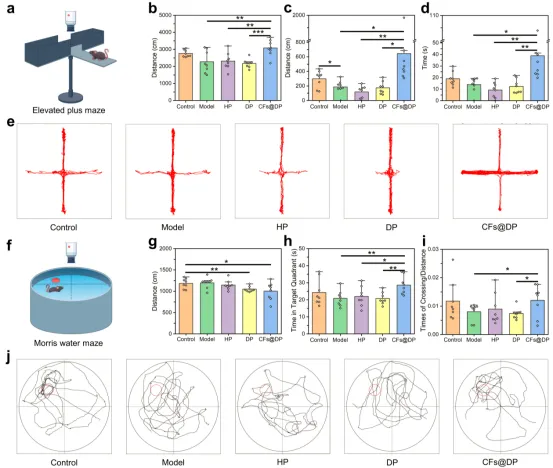
不同处理的EPM、MWM和行为实验
采用高架十字迷宫(EPM)实验和Morris水迷宫(MWM)实验辅助观察行为(图6a和6f)。结果显示,CFs@DP组小鼠的动作距离、张开双臂等行为明显优于其他组(图6b-6e),其认知、学习能力和空间记忆能力更佳(图6g-6j)。
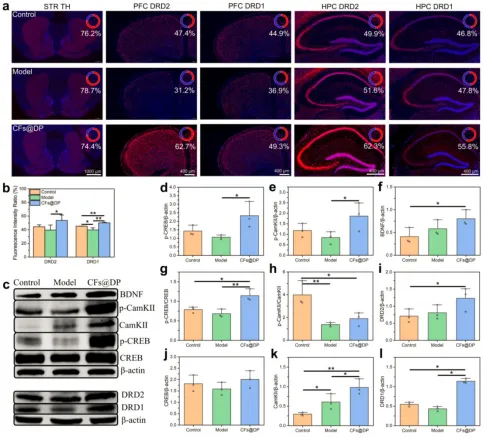
CFs@DP对多巴胺受体密度的影响
通过免疫荧光染色,量化不同脑区蛋白质的密度变化,与模型组相比,用CFs@DP治疗后,前额叶皮质(PFC)中的多巴胺受体D1(DRD1)和多巴胺受体D2(DRD2)密度分别增加了约70%和270%,海马(HPC)中的多巴胺受体密度增加了约40%(D1)和60%(D2),结果表明,CFs@DP有可能通过重塑多巴胺突触来改善焦虑、抑郁和认知缺陷的症状(图7a和图7b)。通过取脑组织进行WB实验,结果表明CFs@DP可能通过激活多巴胺相关信号通路来上调BDNF和p-CaMKⅡ,从而产生抗抑郁和增强认知的作用(图7c-图7l)。
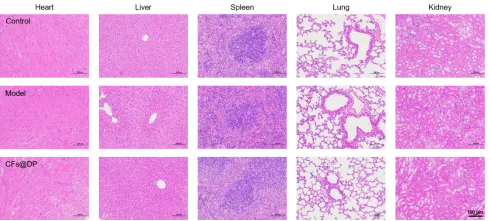
生物安全性评价
H&E染色结果显示CFs@DP组的组织切片没有明显病变,且经过一段时间的观察,CFs@DP组小鼠没有表现出减少进食等不良行为,表明其生物安全性良好。
总结
综上,本文将补铁剂与外周D2受体拮抗剂相结合,构建了近红外和磁性双响应鼻腔给药系统,该系统可崩解释放铁离子和DP。在磁场的帮助下,CFs@DP可以自我封装多巴胺,与嗅觉多巴胺通路受体结合,经嗅觉神经进入大脑,从而介导DRD2和DRD1的密度上调,增加受体的敏感性,以适应DA的缺乏。DR密度的变化最终通过介导AC/cAMP/CREB通路、PLC/IP3/Ca2+/CaMKⅡ通路、BDNF/TrkB通路达到治疗效果。体内实验结果表明,CFs@DP给药系统经鼻腔给药成功到达大脑,并有效改善小鼠在OF、EPM和MWM实验中的行为,精神分裂症的阴性症状(抑郁和焦虑)和认知障碍得到改善,且不会产生导致成瘾和依赖的强烈快感,理论上为治疗药物成瘾提供了可能。
作为一项初步研究,本文展示了D2受体拮抗剂和补铁联合治疗焦虑、抑郁和认知缺陷的前景。未来的研究应侧重于特定的应用场景,考虑年龄范围和适应症等因素,避免滥用造成不必要的伤害。此外,需要研究该系统对神经可塑性的影响机制以及不同脑区和不同受体的治疗敏感性,以规范其应用。
参考信息
https://onlinelibrary.wiley.com/doi/10.1002/adma.202405547
来源: